2. Pathogen - Immunzellinteraktionen
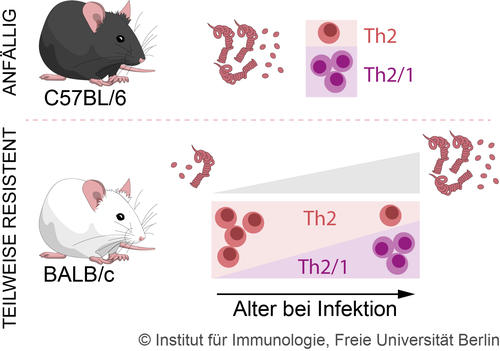
Abb. 1: Effekte des Alterns auf die Immunantwort gegen Nematoden (Kapse et al. 2022)
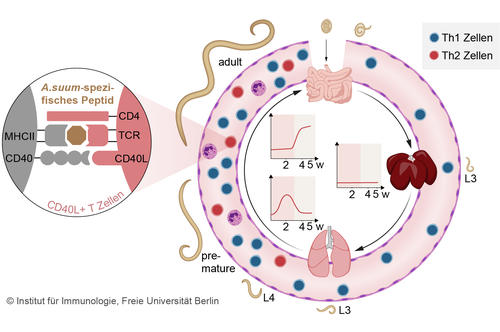
Abb. 2 T-Zellantwort im Verlauf einer A. suum-Infektion im Schwein (Oser et al. 2024)
2.1 Th2/1 Hybridzellen in Nematoden-infizierten Patienten und Mäusen
In Nematoden-Infektionen werden Th2/1-Hybridzellen induziert, von denen wir zeigen konnten, dass diese stabil die Transkriptionsfaktoren der T Helferzellen des Typs Th1 und Th2 exprimieren (Peine et al., 2013). Auch Blutzellen von Patienten, die mit dem Zwergfadenwurm Strongyloides stercoralis infiziert sind, weisen nicht nur signifikant erhöhte Werte von GATA-3+ Th2 Zellen, sondern auch von GATA-3+T-bet+ Zellen auf. DieseTh2/1-Hybridzellen sind somit in menschlichen Infektionen nachweisbar, exprimieren jedoch im Vergleich zu murinen Th2/1-Hybriden höhere Mengen an IFN-g bei sehr geringer GATA-3 Expression (Bock et al., 2017).
Interessanterweise konnten wir auch zeigen, dass die T Zellanzahlen und deren Funktionen sich mit zunehmendem Alter im Organismus in Antwort auf eine Infektion mit Nematoden ändern. In älteren Mäusen, im Vergleich zu jungen Mäusen sind in Antwort auf den Dünndarmnematoden H. polygyrus mehr T Helferzellen des Typs Th1 und der T Hybridzellen zu finden (Abb. 1). Im Gegensatz dazu, sind T Helferzellen des Typs Th2 prominenter in jungen Mäusen. Dieses Phänomen des Alterns geht mit einer erhöhten INF-g Produktion der Mäuse einher (Kapse et al., 2022).
Ausgewählte Publikationen
- Kapse, B.; Zhang, H.; Affinass, N.; Ebner, F.; Hartmann, S.; Rausch, S. (2022): Age-dependent rise in IFN-γ competence undermines effective type 2 responses to nematode infection. Mucosal Immunol; 15(6), S. 1270–1282
- Zhang, H.; Bednář, L.; Heitlinger, E.; Hartmann, S.; Rausch, S. (2022): Whip- and pinworm infections elicit contrasting effector and distinct regulatory responses in wild house mice. Int J Para; 52(8), S. 519–524
- Affinass, N.; Zhang, H.; Löhning, M.; Hartmann, S.; Rausch, S. (2018):Manipulation of the balance between Th2 and Th2/1 hybrid cells affects parasite nematode fitness in mice. Eur J Immunol; 48(12), S. 1958–1964
- Bock, C.N., S. Babu, M. Breloer, A. Rajamanickam, Y. Bhootra, M.-L. Brunn, A. A. Kühl, R. Merle, M. Löhning, S. Hartmann, S. Rausch (2017): Th2/1 hybrid cells occurring in murine and human strongyloidiasis share effector functions of Th1 cells, Frontiers in Cellular and Infection Microbiology, doi: 10.3389/fcimb.2017.00261.
- Peine, M., S. Rausch, C. Helmstetter, A. Fröhlich, A. N. Hegazy, A. A. Kühl, C. G. Grevelding, T. Höfer, S. Hartmann, and M. Loehning (2013): Stable T-bet+GATA-3+ Th1/Th2 hybrid cells arise in vivo, can develop directly from naïve precursors, and limit immunopathologic inflammation. PLoS Biology, 11:e1001633.
Drittmittel: DFG GRK 2046: S. Rausch Projekt B5.
2.2 Tools und T Zellantworten im Schwein
Um T-Zellpopulationen im Schwein in Antwort auf Infektionen zu charakterisieren haben wir den Nachweis linienspezifischer T- Zelltranskriptionsfaktoren sowie Antigen-spezifischer T Zellen im Schwein etabliert (Ebner et al., 2014, Schmidt et al., 2020). Mittels des Markers CD154 können pathogen-spezifische T Zellen im Verlauf einer Infektion analysiert werden. In A. suum-infizierten Schweinen zeigte sich eine lokale, transiente Th2 Antwort in der Lunge und eine Akkumulation von Th2 Zellen im Darm nach der Körpermigration der Larven (Abb. 2), welche parallel begleitet war von einer systemischen Th1 Expansion (Oser et al. 2024). Das Modell Schwein erlaubt die Charakterisierung von Pathogen-spezifischen T-Zellen humanrelevanter Infektionen sowie deren Verteilung in den Organen des infizierten Individuums.
Ausgewählte Publikationen
- Oser, L., Midha, A., Schlosser-Brandenburg, J., Rausch, S., Mugo, R. M.; Kundik, A., Elizalde-Velázquez, L. E., Adjah, J., Musimbi, Z. D., Klopfleisch, R.; Helm, C. S., von Samson-Himmelstjerna, G., Hartmann, S., Ebner, F. (2024): Ascaris suum infection in juvenile pigs elicits a local Th2 response in a setting of ongoing Th1 expansion, Front Immunol; doi: 10.3389/fimmu.2024.1396446
- Schlosser-Brandenburg, J.; Ebner, F.; Klopfleisch, R.; Kühl, A. A.; Zentek, J.; Pieper, R.; Hartmann, S. (2021): Influence of nutrition and maternal bonding on postnatal lung development in the newborn pig. Front Immunol; 12, S. Article 734153
- Schmidt, S.; Ebner, F.; Rosen, K.; Kniemeyer, O.; Brakhage, A. A.; Löffler, J.; Seif, M.; Springer, J.; Schlosser, J.; Scharek-Tedin, L.; Scheffold, A.; Bacher, P.; Kühl, A. A.; Rösler, U.; Hartmann, S. (2020):The domestic pig as human‐relevant large animal model to study adaptive anti‐fungal immune responses against airborne Aspergillus fumigatus. Eur J Immunol; 50(11), S. 1712–1728
- Ebner, F.; Morrison, E.; Bertazzon, M.; Midha, A.; Hartmann, S.; Freund, C.; Álvaro-Benito, M. (2020): CD4+ Th immunogenicity of the Ascaris spp. secreted products. Vaccine; 5, S. Article number: 25
- Ebner, F., P. Schwiertz, S. Steinfelder, R. Pieper, J. Zentek, N. Schütze, C. G. Baums, G. Alber, P. Geldhof, S. Hartmann. 2017. Pathogen-reactive T helper cell analysis in the pig, Frontiers in Immunology, doi: 10.3389/fimmu.2017.00565.
Drittmittel: DFG GRK 2046: F. Ebner Projekt C9.
2.3 Regulation Antigen-präsentierender Zellen in Nematodeninfektionen
Nematoden induzieren regulatorische Monozyten/Makrophagen, welches Fresszellen, und gleichzeitig Antigen-präsentierende Zellen sind. Diese konnten in mit Nematoden-Antigen behandelten Mäusen (Klotz et al., 2011) und im Blut Filarien-infizierter Patienten in Südindien nachgewiesen werden (O’Regan et al., 2014).Diese regulatorischen Makrophagen beeinflussen unabhängige entzündliche Reaktionen. Die Verabreichung von Nematoden-induzierten regulatorischen Makrophagen in unabhängigen entzündlichen Geschehen unterdrückt diese und ruft eine Hochregulation des anti-inflammatorischen Zytokins IL-10 durch T Helferzellen hervor (Ziegler et al., 2015). Somit können Nematoden-induzierte regulatorische Makrophagen den Wirt vor der durch die Nematoden-hervorgerufenen Pathologie, aber auch vor unabhängigen mukosalen Entzündungen schützen (Steinfelder et al., 2016).
Ebenso nutzen der porzine Darmnematode Ascaris suum die von ihm sekretierten/exkretierten (ES) Produkte um die wichtigste Antigen-präsentierende Zelle, die dendritische Zelle, zu modulieren. Es kommt zu einer Veränderung wichtiger Stimulations-relevanter Oberflächenmarker und einer Suppression pro-entzündlicher Zytokine wie IL-12 und TNF-a (Hamid et al., 2022).
Ausgewählte Publikationen
- Hamid, B.; Ebner, F.; Bechtold, L.; Kundik, A.; Rausch, S.; Hartmann, S. (2022):Ascaris suum excretory/secretory products differentially modulate porcine dendritic cell subsets.Front Immunol; 13, S. Artikel 1012717
- Hamid, B.; Schlosser-Brandenburg, J.; Bechtold, L.; Ebner, F.; Rausch, S.; Hartmann, S. (2021): Early immune initiation by porcine cells following Toxoplasma gondii infection versus TLR ligation. Microorganisms; 9(9), S. Artikel 1828
- Schlosser-Brandenburg, J.; Ebner, F.; Klopfleisch, R.; Kühl, A. A.; Zentek, J.; Pieper, R.; Hartmann, S. (2021): Influence of nutrition and maternal bonding on postnatal lung development in the newborn pig. Front Immunol; 12, S. Article 734153
- Strandmark, J.; Steinfelder, S.; Berek, C.; Kühl, A.; Rausch, S.; Hartmann, S. (2016): Eosinophils are required to suppress Th2 responses in Peyer’s patches during intestinal infection by nematodes. Mucosal Immunol; 10, S. 661–672
- Steinfelder, S., N.L. O’Regan, S. Hartmann (2016): Diplomatic Assistance: Can Helminth modulated macrophages act as treatment for inflammatory disease, PLoS Pathogens, DOI:10.1371
- Ziegler, T., S. Rausch, S. Steinfelder, C. Klotz, M.R. Hepworth, A. Kühl, P-C- Burda, R. Lucius, S. Hartmann (2015): A novel regulatory macrophage (Mreg) induced by a helminth molecule instructs IL-10 in CD4+ T-cells and protects against mucosal inflammation, J Immunology, 194:1555-1564.
Drittmittel: DFG GRK 2046: S. Hartmann Projekt B4