Arbeitsgruppe "Virale Integration, Tumorigenese und Virus-Evolution"
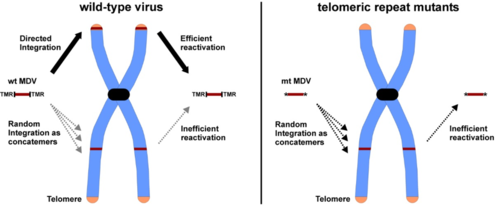
Abb. 1: MDV Integration (bitte anklicken)
Bildquelle: Institut für Virologie
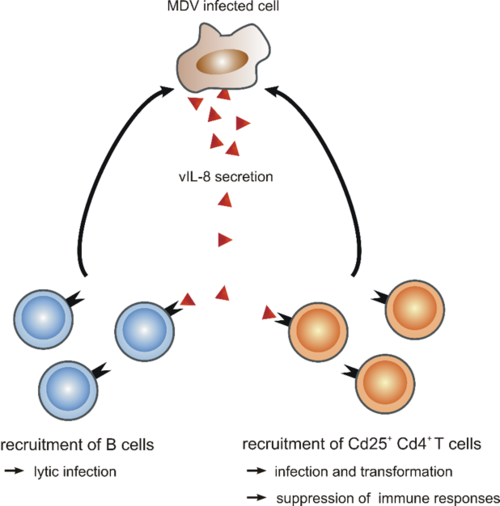
Abb. 2: Das virale Chemokin vIL-8 (bitte anklicken)
Bildquelle: Institut für Virologie
Die Arbeitsgruppe Kaufer beschäftigt sich mit den molekularen Mechanismen und der Pathogenese verschiedener Herpesviren. Dazu gehört das hoch onkogene Marek’s Disease Virus (MDV), Varizella-Zoster-Virus (VZV) und das humane Herpesvirus 6 (HHV-6). MDV verursacht tödliche Lymphome in Hühnern und hohe wirtschaftliche Schäden in der Geflügelhaltung. In den letzten Jahrzenten sind immer virulentere MDV Stämme entstanden, die resistent gegenüber den ersten beiden Impfstoffgenerationen (HVT und SB-1) und auch effizient in Tieren replizieren die mit Impfstoffen der 3. Generation (CVI988/Rispens) geimpft wurden. Wir haben in den letzten Jahren eine Reihe von Mechanismen der MDV Pathogenese und Tumorentstehung entschlüsselt. Dazu gehören Projekte zur Rolle des viralen Chemokins vIL-8, der Virus kodierten Telomerase RNA (vTR) und Telomersequenzen, die sich in den Enden des Virusgenoms befinden.
Integration von Herpesviren
Einige Herpesviren, darunter das onkogene Marek’s Disease Virus (MDV) und das humane Herpesvirus 6 (HHV-6), integrieren ihre genetische Information in die Telomere latent infizierter Zellen, was die Erhaltung des viralen Genoms sicherstellt. MDV, HHV-6 und einige weitere Herpesviren beinhalten repetitive Sequenzen (TTAGGG)n, an den Enden des linearen Genoms, die identisch mit Telomersequenzen der zellulären DNA sind. Diese konservierten, repetitiven Telomersequenzen (TMR) in den Virusgenomen lassen auf einen konservierten Integrationsmechanismus schließen. Das MDV-Genom beinhaltet zwei repetitive Telomersequenzen: eine lange Telomerregion (mTMR) mit einer variablen Anzahl von 27 bis 100 repetitiven Einheiten und eine kurze Telomerregion (sTMR), die invariabel aus 6 repetitiven Einheiten besteht. Wir haben vor kurzem gezeigt, dass die Telomersequenzen von MDV essentiell für die Integration des viralen Genoms in die Telomere der Zielzellen ist und dass Integration entscheidend für die Lymphomagenese und die Reaktivierung des Virus aus latent infizierten Zellen ist (Abbildung 1) (1-3). Zudem konnten wir zeigen, dass auch andere Herpesviren, die Telomersequenzen am Ende ihres Genoms besitzen, diesen Mechanismus zur Integration verwenden (4-7).
Das virale Chemokin vIL-8
Um die Rolle des vIL-8 Chemokins zu analysieren, haben wir MDV Mutanten generiert, die das Chemokin nicht exprimieren. Damit konnten wir zeigen, dass vIL-8 bei einer Infektion über den natürlichen Infektionsweg, eine essentielle Rolle in der Pathogenese von MDV spielt (8). Um die Mechanismen zu ergründen, haben wir rekombinantes vIL-8 generiert und konnten damit demonstrieren, dass das Chemokin B-Zellen rekrutiert, die die Zielzellen für die lytische Infektion von MDV sind (Abbildung 2). Zudem konnten wir zeigen, dass vIL-8 auch an CD4/CD25 T-Zellen bindet und diese rekrutiert. Die MDV-induzierten Tumorzellen sind auch CD4/CD25 T-Zellen, was darauf schließen lässt, dass MDV diese Zellen rekrutiert und nach der Infektion transformiert. Vor kurzem haben wir den Rezeptor für vIL-8 bestimmt und identifizieren und charakterisieren gerade die zellulären Homologe von vIL-8 (9, 10).
Die Virus kodierte Telomerase RNA (vTR)
Ein weiterer wichtiger Virulenzfaktor ist die MDV-kodierte Telomerase RNA (vTR). Diese RNA hat eine hohe Homologie mit der zellulären Telomerase RNA des Huhns (chTR). vTR ist, wie chTR, ein Teil des Telomerasekomplexes und verleiht diesem eine höhere Aktivität im Vergleich mit dem zellulären chTR. Wir konnten in unseren Arbeiten zeigen, dass vTR auch Funktionen außerhalb der Telomerasekomplexes hat und dass diese essentiell für eine effiziente Transformation und Induktion von Lymphomen sind (11). Des Weiteren konnten wir zeigen, dass andere RNAs wie das zelluläre chTR sowie die Epstein-Barr virus-encoded RNAs transformierende Eigenschaften vergleichbar mit vTR besitzen (12). In weiteren Arbeiten konnten wir zeigen, dass die Expression von vTR mit einer Mutation in der Matrizensequenz zur Apoptose in Tumorzellen führt (1). Wir führten diese Mutation in das MDV Genom ein und konnten demonstrieren, dass diese Sequenz die lytische Replikation in infizierten Tieren stark reduziert und die Tumorentstehung verhindert. Diese apathogenen rekombinanten Viren wurden zudem erfolgreich als Impfstoff eingesetzt und werden nun in größeren Maßstab in einer Industriekooperation getestet (1).
Herpesvirus Evolution
In den letzten Jahrzenten sind immer virulentere MDV Stämme entstanden, die den Impfschutz der ersten beiden Impfstoffgenerationen (HVT und SB-1) überwinden. Zudem können diese Viren auch effizient in Tieren replizieren die mit Impfstoffen der 3. Generation (CVI988/Rispens) geimpft wurden. Trotz langjähriger Forschung sind die exakten Veränderungen im MDV-Genom, die zur Virulenz und Impfstoffresistenz beitragen, nicht bekannt. Im Rahmen meiner Lichtenberg Professur untersuchen wir, ob Veränderungen im Hauptonkogen meq direkt zu Virulenz beitragen. Des Weiteren werden wir erforschen, ob der partielle Impfschutz die Evolution von virulenteren Virusstämmen begünstigt. Die Erkenntnisse über den Evolutionsprozess der Viren wird uns erlauben, neue Impfstoffe zu entwickeln, die einen besseren Schutz bieten und möglicherweise die Evolution der Viren verhindern.
Referenzen:
- Kaufer BB, Jarosinski KW, Osterrieder N. 2011. Herpesvirus telomeric repeats facilitate genomic integration into host telomeres and mobilization of viral DNA during reactivation. The Journal of experimental medicine 208:605-615.
- Greco A, Fester N, Engel AT, Kaufer BB. 2014. Role of the Short Telomeric Repeat Region in Marek's Disease Virus Replication, Genomic Integration, and Lymphomagenesis. J Virol 88:14138-14147.
- Osterrieder N, Wallaschek N, Kaufer BB. 2014. Herpesvirus Genome Integration into Telomeric Repeats of Host Cell Chromosomes. Annu Rev Virol 1:215-235.
- Wallaschek N, Sanyal A, Pirzer F, Gravel A, Mori Y, Flamand L, Kaufer BB. 2016. The Telomeric Repeats of Human Herpesvirus 6A (HHV-6A) Are Required for Efficient Virus Integration. PLoS Pathog 12:e1005666.
- Wallaschek N, Gravel A, Flamand L, Kaufer BB. 2016. The putative U94 integrase is dispensable for human herpesvirus 6 (HHV-6) chromosomal integration. J Gen Virol 97:1899-1903.
- Gravel A, Dubuc I, Wallaschek N, Gilbert-Girard S, Collin V, Hall-Sedlak R, Jerome KR, Mori Y, Carbonneau J, Boivin G, Kaufer BB, Flamand L. 2017. Cell culture systems to study Human Herpesvirus 6A/B Chromosomal Integration. Journal of Virology doi:10.1128/jvi.00437-17.
- Kaufer BB, Flamand L. 2014. Chromosomally integrated HHV-6: impact on virus, cell and organismal biology. Curr Opin Virol 9:111-118.
- Engel AT, Selvaraj RK, Kamil JP, Osterrieder N, Kaufer BB. 2012. Marek’s disease viral interleukin-8 promotes lymphoma formation through targeted recruitment of B cells and CD4+ CD25+ T cells. J Virol 86.
- Schermuly J, Greco A, Hartle S, Osterrieder N, Kaufer BB, Kaspers B. 2015. In vitro model for lytic replication, latency, and transformation of an oncogenic alphaherpesvirus. Proc Natl Acad Sci U S A 112:7279-7284.
- Haertle S, Alzuheir I, Busalt F, Waters V, Kaiser P, Kaufer BB. 2017. Identification of the Receptor and Cellular Ortholog of the Marek's Disease Virus (MDV) CXC Chemokine. Frontiers in Microbiology 8.
- Kaufer BB, Trapp S, Jarosinski KW, Osterrieder N. 2010. Herpesvirus telomerase RNA(vTR)-dependent lymphoma formation does not require interaction of vTR with telomerase reverse transcriptase (TERT). PLoS Pathog 6:e1001073.
- Kheimar A, Kaufer BB. 2018. Epstein-Barr virus-encoded RNAs (EBERs) complement the loss of Herpesvirus telomerase RNA (vTR) in virus-induced tumor formation. Scientific Reports 8:209.